Correction
Exercice : Production du dichlore en laboratoire
1. Ecrire les demi-équations d'oxydoréduction.
- Cl2(g) + 2e- = 2Cl-(aq)
- MnO4- + 8H+ + 5e- = Mn2+ + 4H2O
2. Ecrire l'équation complète de la réaction chimique.
Les réactifs sont placés à gauche. La première équation est multipliée par 5, et la deuxième par 2,
pour permettre la suppression des électrons de l'équation complète.
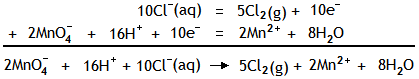
Sous cette forme, l'équation est parfaitement équilibrée, mais présente des charges globales non nulles dans chaque membre. C'est normal puisque déjà ne figure pas dans cette équation, les ions spectateurs. Ajoutons 2 ions K+ de chaque côté, pour retrouver notre permanganate de potassium, et aussi 6Cl- pour équilibrer les ions H+ de notre acide chlorhydrique. Nous obtenons alors l'équation complète :
2KMnO4 + 16HCl → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
3. On dispose de 31,6 grammes de KMnO4.
3.a. Calculer la masse molaire du KMnO4.
M(KMnO4) = M(K) + M(Mn) + 4M(O) = 39,1 + 54,9 + 4 × 16 = 158 g·mol-1
3.b. Déduire du résultat précédent la quantité de matière de KMnO4.
n(KMnO4) = m(KMnO4) / M(KMnO4) = 31,6 / 158 = 0,2 mol.
3.c. Construire le tableau d'avancement de la réaction.
| Avancement | 2MnO4- + 16H+ + 10Cl- → 5Cl2 + 2Mn2+ + 8H2O | ||||||
| Etat initial | x = 0 | n1 | n2 | n3 | 0 | 0 | 0 |
| Etat intermédiaire | x | n1 - 2x | n2 - 16x | n3 - 10x | 5x | 2x | 8x |
| Etat final | xmax | n1 - 2xmax | n2 - 16xmax | n3 - 10xmax | 5xmax | 2xmax | 8xmax |
On considère ici que le réactif limitant est le permanganate de potassium.
Par conséquent : n1 - 2xmax = 0
Soit encore : xmax = n1 / 2 = 0,2 / 2 = 0,1 mol.
3.d. Quelle volume maximale de dichlore peut-on obtenir ?
n(Cl2) = 5xmax = 5 × 0,1 = 0,5 mol.
V(Cl2(g)) = n(Cl2) × Vm = 0,5 × 24 = 12 Litres.