Equation complète d'oxydo-réduction
Nous allons voir ici comment à partir de deux demi-équations chimiques d'oxydo-réduction, nous pouvons obtenir une équation complète.
1. Exemple simple
Dans l'exemple qui nous a servi d'introduction, la réaction chimique du sulfate de cuivre avec le zinc nous a donné les deux demi équations :
- Cu2+ + 2e- = Cu
- Zn2+ + 2e- = Zn
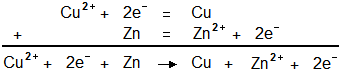
Réécrivons les équations en plaçant cette fois les réactifs à gauche, et les produits à droite.
Puis ajoutons les ensemble. Le signe "=" est devenu une flèche car la réaction possède un sens.
Nous pouvons maintenant supprimer les 2 électrons qui apparaîssent de chaque côté de l'équation,
ce qui donne finalement :
Cu2+ + Zn → Cu + Zn2+
Cette équation nous montre que le zinc a été oxydé par le cuivre (qui est l'oxydant), et on dit aussi que l'oxygène a été "réduit" par le zinc (qui est le réducteur).
2. Exemple ou le nombre d'électrons est différent dans chaque demi-équation
On observe une réaction d'oxydo-réduction entre le cuivre et le nitrate d'argent.
Les couples redox qui interviennent ici sont :
Ag+ / Ag et Cu2+ / Cu
Ecrivons les demi-équations :
- Ag+ + e- = Ag
- Cu2+ + 2e- = Cu
Les réactifs sont le cuivre et l'ion Ag+ se trouvant dans le nitrate d'argent. Plaçons donc ces réactifs à gauche et ce qui reste (les produits) à droite.
- Ag+ + e- = Ag
- Cu = Cu2+ + 2e-
Pour faire disparaitre les électrons en additionnant ces deux demi équations, il suffit de multiplier celle du haut par deux.
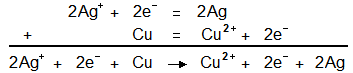
On obtient alors après élimination des électrons :
2Ag+ + Cu → 2Ag + Cu2+
Exercice : Production du dichlore en laboratoire
Une solution rapide pour obtenir du dichlore gazeux (Cl2(g)) en laboratoire
est de verser de l'acide chlorhydrique sur des cristaux de permanganate
de potassium (KMnO4). Les couples oxydoréducteurs mis en jeux sont :
Cl2(g) / Cl-(aq) et
MnO4- / Mn2+
1. Ecrire les demi-équations d'oxydoréduction.
2. Ecrire l'équation complète de la réaction chimique.
3. On dispose de 31,6 grammes de KMnO4.
a) Calculer la masse molaire du KMnO4.
b) Déduire du résultat précédent la quantité de matière de KMnO4.
c) Construire le tableau d'avancement de la réaction.
d) Quelle volume maximale de dichlore peut-on obtenir ?
Données : M(K)=39,1 g·mol-1, M(Mn)=54,9 g·mol-1, et M(O)=16 g·mol-1. Vm=24 L.